
Como calcular a massa atômica YouTube
La massa atomica relativa si calcola sommando la massa dei protoni e dei neutroni presenti nel nucleo di un atomo. Si prende in considerazione il peso atomico degli isotopi e la loro abbondanza percentuale nella natura. La formula è: Massa Atomica Relativa (u) = (Abbondanza Isotopo1 * Massa Isotopo1 + Abbondanza Isotopo2 * Massa Isotopo2.
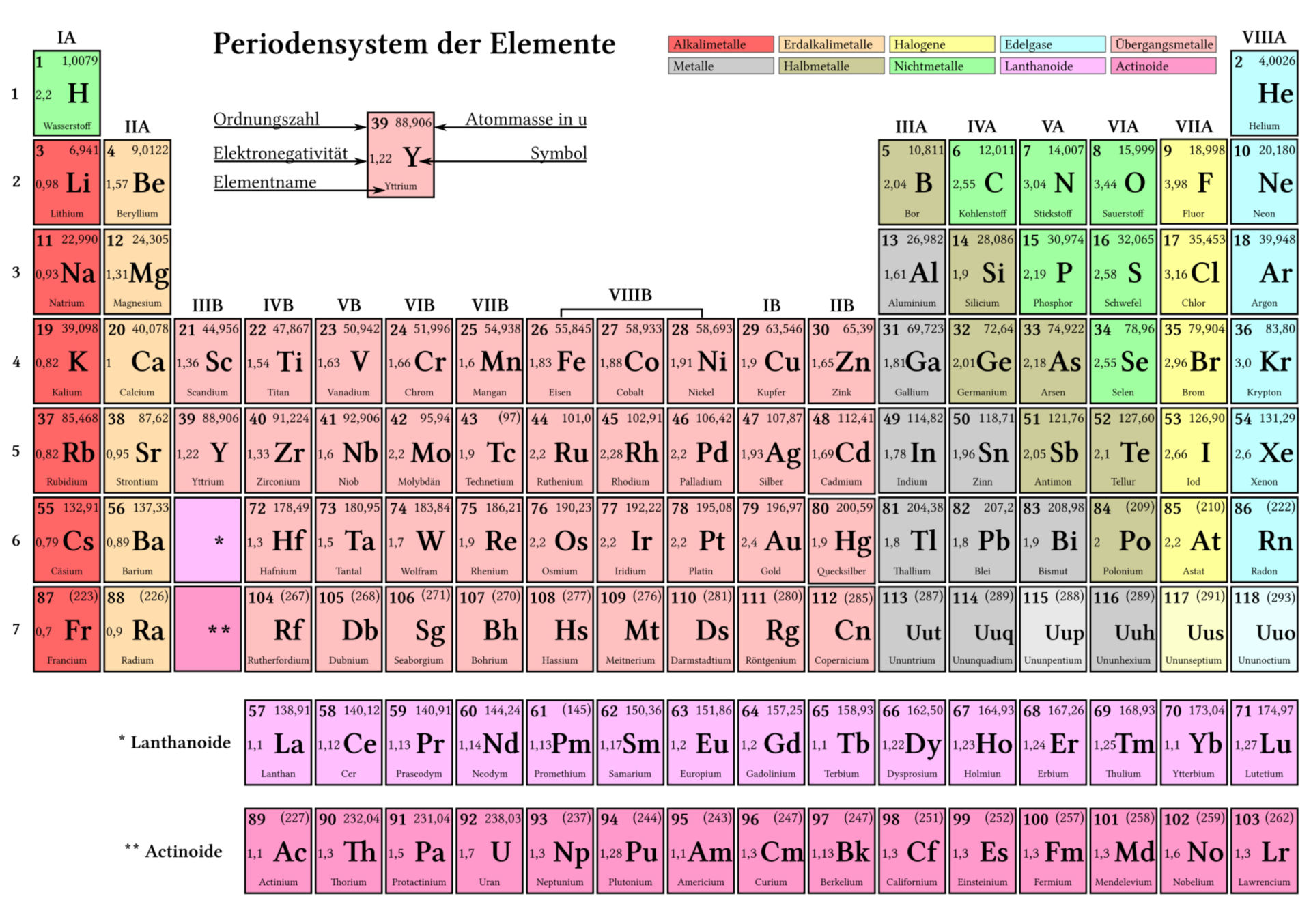
Tavola periodica degli elementi simbolo, nome, massa atomica e numero atomico DocCheck
Trova la massa atomica relativa di ciascun elemento che costituisce il composto. Puoi trovare questo dato grazie alla tavola periodica. Si tratta del numero che viene scritto sotto il simbolo atomico dell'elemento. Proprio come descritto nel primo metodo, per trovare la massa molare ti basta moltiplicare questo numero per 1 g/mol.

PPT Massa atomica relativa PowerPoint Presentation, free download ID5804595
Differenza tra massa atomica e peso atomico. Come anticipato, massa atomica e peso atomico sono due grandezze differenti che si usano per indicare la massa di un atomo. Nello specifico: la massa atomica è la massa di un atomo espressa in unità di misura della massa (uma, grammi, chilogrammi o altre misure della massa del Sistema Internazionale);

NUMERO ATOMICO, NUMERO DI MASSA ATOMICA ED ISOTOPI YouTube
Massa molecolare relativa. La massa di una molecola, detta massa molecolare, è uguale alla somma delle masse atomiche di tutti gli atomi che compongono la molecola. Vediamo come eseguire il calcolo della massa molecolare di CH 3 CH 2 Cl. 2 atomi di C = 2 · 12,01 = 24,02 u. 5 atomi di H = 5 · 1,01 = 5,05 u. 1 atomi di Cl = 1 · 35,45 = 35,45 u.
Federica.EU Chimica Generale 1. La struttura atomica della materia
Tenendo presente che sia la massa atomica che la massa molecolare sono grandezze generalmente comprese tra 10-22 e 10-24 grammi,. Tags: come si calcola la mole di una sostanza - definizione e formula della mole - capire il concetto di mole. Ultima modifica: 07/12/2023. Contattaci; Staff e Collaboratori;

Cómo calcular la masa atómica promedio 8 Pasos
zione che esiste tra le masse dell'idrogeno (H), del carbonio (C) e dell'ossigeno (O) nel glucosio (C6H12O6) si trova anche tra i valori che esprimono le percentuali dei tre elementi (6,7% : 40% : 53,3% = 1 : 6 : 7,9). guente: la massa atomica dell'elemento sta alla massa molecolare del composto come x sta a 100.

Como calcular a massa atômica de um elemento com as massas atômicas de seus isótopos YouTube
2) Somma di protoni e neutroni per un singolo atomo. Per calcolare la massa atomica di un singolo atomo di un elemento, somma la massa di protoni e neutroni. Esempio: trova la massa atomica di un isotopo di carbonio che ha 7 neutroni . Puoi vedere dalla tavola periodica che il carbonio ha un numero atomico di 6, che è il suo numero di protoni.

unità di massa atomica DrBeckmann
La relazione tra massa, quantità di sostanza, volume e numero di particelle. La massa atomica (m a) di un atomo è la massa di quel singolo atomo espressa in unità di massa: grammi o kilogrammi.. Tuttavia, poiché può assumere valori compresi tra i 10 −25 kg e i 10 −27 kg, è solitamente espressa in Da (dalton, derivata dal nome di John Dalton) o unità di massa atomica unificata (u.m.a.

atomo massa atomica e mole YouTube
Calcola il numero atomico, la massa atomica e la carica utilizzando le seguenti formule: Z = 16. A = 16 + 16 = 32. z = 16 - 18 = -2. Naturalmente, non devi eseguire tutti questi calcoli a mano! Digita tre valori qualsiasi e vedrai che il calcolatore per gli atomi farà tutto il lavoro per te. Trovi che questo calcolatore è utile?

Cómo se calcula la masa atómica de un elemento YouTube
In conclusione, sapendo che la deviazione subita dagli ioni dipende dalla loro massa e che la deviazione subita dallo ione 16 O + risulta inferiore a quella dello ione 12 C +, è possibile affermare che la massa dell'atomo di ossigeno è più grande di quella dell'atomo di carbonio.Dalla differenza tra le due deviazioni si può inoltre stabilire che il rapporto O/C tra le masse dei due atomi.

massa atomica
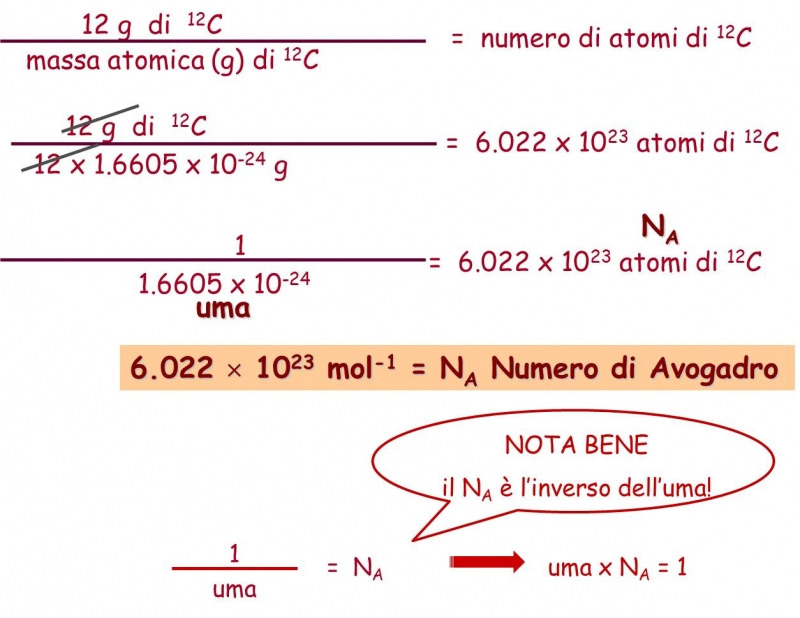
massa atòmica Massa di riposo di un atomo misurata in unità di m.a. (u). L'unità di m.a. è definita come la dodicesima parte della m. dell'isotopo 12 C del carbonio ed è pari a 1,6605655×10-27 kg. Il numero intero che si avvicina di più alla m.a. dell'elemento e che coincide con il numero totale di protoni e neutroni presenti nel suo nucleo prende il nome di numero di massa.

PPT CHIMICA PowerPoint Presentation ID4581089
Le masse atomiche, quando sono espresse in uma come avviene sulla tavola periodica, sono tecnicamente numeri privi di unità di misura. Tuttavia, basta moltiplicarle per 1 g/mol per ottenere un valore utilizzabile della massa molare, cioè la massa espressa in grammi di una mole di atomi del dato elemento. 3.

gli ATOMI struttura interna e massa Benvenuti su profcalabria!
L' unità di massa atomica (simbolo u, abbreviato uma) è un'unità di misura della massa che non appartiene al Sistema Internazionale, e che per definizione corrisponde alla dodicesima parte della massa dell'atomo di carbonio-12. 1 unità di massa atomica equivale a circa 1,66054×10-27 chilogrammi o, equivalentemente, a 1,66054×10-24 grammi. Sui libri di testo di Fisica, Chimica o Biologia.

Elementi, isotopi e massa atomica YouTube
La massa atomica degli atomi, ioni, o dei nuclei atomici è leggermente inferiore alla somma delle masse dei loro protoni costituenti, dei loro neutroni e dei loro elettroni, a causa della perdita di massa dovuta all'energia di legame (come da E = mc 2 ). La massa atomica (ma) di un atomo è la massa di quel singolo atomo espressa in unità di.

Dall'unità di massa atomica alla massa molare YouTube
L'unità di massa atomica è definita come la dodicesima parte della massa dell'isotopo ^12C del carbonio ed è pari a 1,6605655×10^-27 kg. La massa atomica di un atomo è determinata dalla somma delle masse dei suoi componenti, cioè dei protoni, dei neutroni e degli elettroni.

PPT “La Mole” Principi di stechiometria PowerPoint Presentation, free download ID4354029
Il peso atomico. Il peso atomico (o massa atomica relativa) è il rapporto tra la massa atomica di un elemento chimico X e la massa atomica del carbonio-12 ( 12 C). pesoatomico X = mX m12C = mX 1amu p e s o a t o m i c o X = m X m 12 C = m X 1 a m u. Indica la massa relativa di un elemento chimico rispetto all'unità di massa atomica (u.m.a.).
- 3 In Mezzo A Noi I Racconti Di Arcadia
- Scooby Doo E La Leggenda Del Vampiro
- The Iron Claw Uscita Italia
- Cast Di Il Bambino E Il Poliziotto
- Canapi Delle Barche A Vela
- Un Uomo E Due Donne
- Riassunto Del Viaggio Al Centro Della Terra
- Dove Si Trova Val Trebbia
- Attrice Miracolo Nella 34a Strada
- è Pronto O Mangià Recensioni