
Acido Fosforico 35Kg, H3PO4 Acido Liquido para Uso Agricola
L'acqua è una base debole mentre il suo acido coniugato H 3 O+ è forte. Si consideri la dissociazione dell'ammoniaca: NH 3 + H 2 O ⇄ NH 4 + + OH - L'ammoniaca è una base debole e lo ione ammonio che è il suo acido coniugato è forte mentre l'acqua che è un acido debole ha, come base coniugata OH - che è forte.

ACIDI E BASI FORTI E DEBOLI YouTube
Basi forti e basi deboli. Gli acidi e le basi sono composti sia organici che inorganici che rivestono un ruolo primario nell'ambito della chimica. Inoltre le soluzioni tampone biologiche costituite da acidi e basi deboli aiutano a mantenere il corpo ad un pH corretto in modo che i processi biochimici possano avvenire in modo ottimale.

Diluendo soluzioni di un acido forte o debole
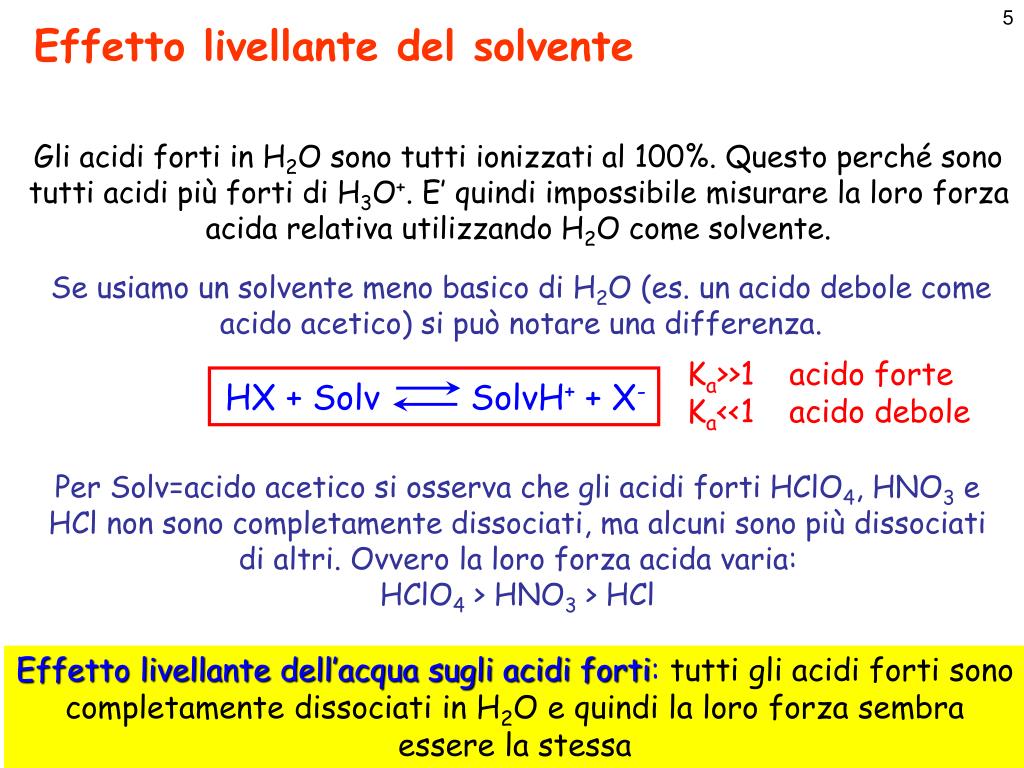
In merito all'effetto livellante dell'acqua, si deve tenere presente che esso si manifesta soltanto per gli acidi forti dato che, essendo in acqua completamente ionizzati, a parità di concentrazione sono in grado di generare lo stesso numero di ioni H 3 O + indipendentemente dalla loro natura. Se gli stessi acidi vengono però sciolti in un solvente più acido dell'acqua (ad esempio un.

Hcl Acido Forte O Debole princeselsa
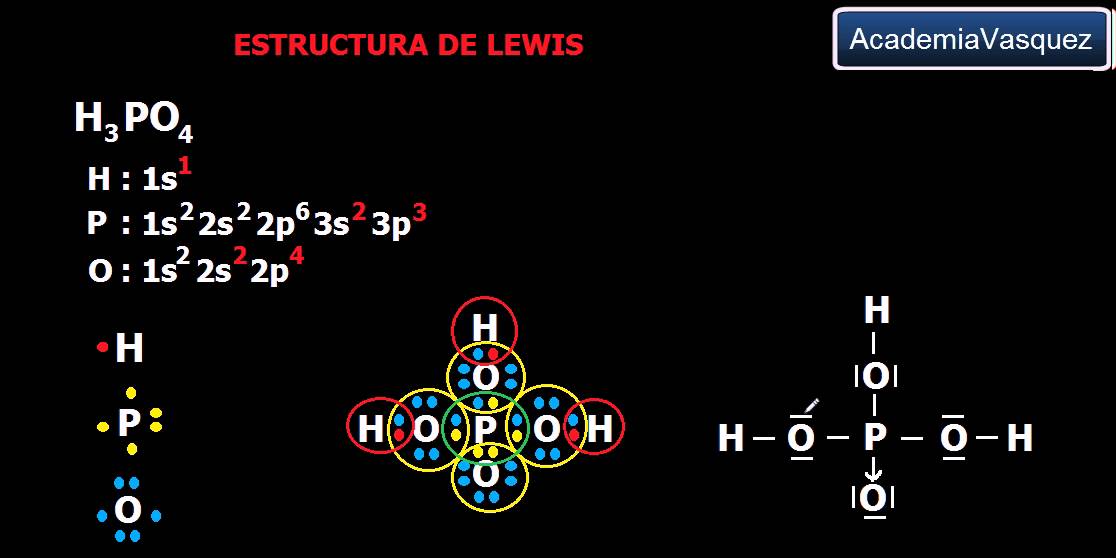
Acido fosforico. L' acido fosforico, o acido ortofosforico, è un acido inorganico di formula bruta H 3 PO 4, formula semistrutturale O=P (OH) 3. Si ottiene in forma pura principalmente dalla reazione dell' anidride fosforica con acqua in quantità stechiometrica, secondo la reazione: La sua composizione elementare fu determinata per la prima.

Diluendo soluzioni di un acido forte o debole
Per determinare se un acido è forte o debole, puoi fare riferimento alla sua costante di dissociazione acida (Ka) o alla sua capacità di ionizzarsi in soluzione.. (H2CO3) e l'acido fosforico (H3PO4). Perché un acido e debole? Ultimo aggiornamento: 18 ottobre 2023. Un acido è debole perché la sua capacità di donare ioni H+ è limitata.

Diluendo soluzioni di un acido forte o debole
In questo video troverete alcuni suggerimenti veloci per poter distinguere un acido debole da un acido forte. Riuscirete così ad affrontare meglio i test a s.

Diluendo soluzioni di un acido forte o debole
A. Ácido débil. Ácido fuerte. B. Ácido fuerte. Mostrar la tabla periódica. Reportar un problema. Aprende gratuitamente sobre matemáticas, arte, programación, economía, física, química, biología, medicina, finanzas, historia y más. Khan Academy es una organización sin fines de lucro, con la misión de proveer una educación gratuita.

🧪 QUÍMICA BÁSICA O ácido fosfórico apresenta fórmula molecular H3PO4 YouTube
Capire la forza di un acido. Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+.

Símbolo Vectorial Del Compuesto Del ácido Fosfórico H3po4 Constituido Por átomos Y Moléculas De
La maggior parte degli acidi organici sono acidi deboli. Ecco un elenco parziale, ordinato dal più forte al più debole. H O 2 C 2 O 2 H - acido ossalico. H 2 SO 3 - acido solforoso. HSO 4 - - ione idrogeno solforato. H 3 PO 4 - acido fosforico. HNO 2 - acido nitroso. HF - acido fluoridrico. HCO 2 H - acido metanoico.

Nombre Del Compuesto H3po4 lios
Forza degli acidi e delle basi: acidi e basi deboli; acidi e basi forti. Gli acidi e le basi, posti in soluzione acquosa, assumono comportamenti diversi, in base ai quali vengono classificati come forti o deboli. Sono considerati forti quegli acidi e quelle basi che in acqua sono completamente ionizzati.

Qual o número de moléculas em 294g de ácido fosfórico (H3PO4) YouTube
Gli acidi forti si dissociano completamente in soluzioni acquose, cosicché tutte le loro molecole perdono almeno un protone (H + ) che forma uno ione idronio (H 3 O + ) con la molecola d'acqua, mentre gli acidi deboli si dissociano solo parzialmente. Gli acidi forti sono pochissimi, gli acidi inorganici forti sono solo sette, quindi per.

Diluendo soluzioni di un acido forte o debole
Alcuni esempi di acidi deboli sono l'acido acetico (CH3COOH), l'acido carbonico (H2CO3) e l'acido fosforico (H3PO4). È importante notare che la classificazione di un acido come forte o debole dipende dalla sua capacità di dissociarsi in soluzione acquosa e non dalla sua pericolosità o corrosività.
H3po4
La forza di un acido è rappresentata dalla costante di dissociazione acida, Ka. Il fatto che un acido sia forte o debole non ha niente a che fare con la concentrazione o la diluizione della soluzione. Per esempio, un acido forte come l'acido solforico non diventerebbe un acido debole semplicemente se venisse diluito.

Acido fosforico ou ácido ortofosfórico é um composto químico fórmula molecular H3PO4. E o ácido
il acido fosforico è un oxo acido di fosforo che ha una formula chimica H 3 PO 4. È costituito da un acido minerale in cui tre protoni acidi sono legati all'anione fosfato (PO 4 3-).Sebbene non sia considerato un acido forte, il suo uso improprio può rappresentare un rischio per la salute. Può essere trovato in due stati: come un solido sotto forma di grossi cristalli ortorombici, o un.
Hno3 Acido Forte O Debole thaqabia
L'acido fosforico è caratterizzato da proprietà chimiche e fisiche peculiari. È un acido debole a tre protoni, il che significa che può rilasciare fino a tre ioni idrogeno (H +) in soluzione. In termini di aspetto fisico, l'acido fosforico puro è un solido cristallino a temperatura ambiente, ma è comunemente disponibile in forma di soluzione acquosa concentrata.

PPT curva di titolazione base deboleacido forte PowerPoint Presentation ID4898016
Per determinare se un acido è forte o debole, è possibile considerare diversi fattori: 1. Dissociazione ionica. Un acido forte si dissocia completamente in soluzione acquosa, producendo un elevato numero di ioni H+. Un acido debole, invece, si dissocia solo parzialmente, generando un numero limitato di ioni H+. 2.
- Tutti I Film Di Naruto
- Cagiva Aletta Oro S2 125
- Parenti Nello Stesso Posto Di Lavoro
- Che Ore Sono Adesso A Bangkok
- Cast L Amore è Eterno Finchè Dura
- Tiziano Amore Sacro E Amor Profano
- Chi Sa Fare Sa Capire
- Quando Esce La 4 Stagione Di Demon Slayer
- Cose Da Fare A Castel San Vincenzo
- Iphone 14 Pro Max Viola Scuro